Sisältö
Massaprosentti määrittää kunkin alkuaineen prosenttiosuuden, joka muodostaa kemiallisen yhdisteen. Tämän arvon löytämiseksi tarvitaan yhdisteen alkuaineiden massa grammoina / moolina tai grammamäärä, jota käytetään ratkaisun luomiseen. Massaprosentti voidaan laskea yksinkertaisella tavalla käyttäen peruskaavaa, joka jakaa alkuaineen (tai liuenneen aineen) massan yhdisteen (tai liuoksen) massalla.
Askeleet
Menetelmä 1/2: Massaprosentin etsiminen annetuilla massoilla
- Määritä yhdisteen massaprosentin yhtälö. Yhdisteen peruskaava on: massaprosentti = () x 100. Tulos on kerrottava lopulla 100: lla, jotta arvot voidaan ilmaista prosentteina.
- Kiinnostavan kemiallisen yhdisteen massa on tehtävässä annettu massa. Jos tätä arvoa ei anneta, katso seuraavaa menetelmää ja opi löytämään prosenttiosuus massasta, kun massaa ei anneta.
- Yhdisteen kokonaismassa lasketaan lisäämällä kaikkien alkuaineiden massat, joita käytetään yhdisteen tai liuoksen muodostamiseen.
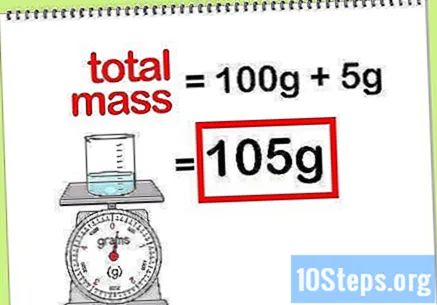
Laske yhdisteen kokonaismassa. Kun tiedät kaikkien lisättyjen alkuaineiden tai yhdisteiden massa-arvon, sinun on vain lisättävä ne yhdisteen tai lopullisen liuoksen massan laskemiseksi. Tämä arvo on nimittäjä laskettaessa massaprosenttia.- Esimerkiksi: Kuinka suuri on 5 g natriumhydroksidia 100 g: aan vettä liuotettuna?
- Yhdisteen kokonaismassa on natriumperoksidin määrä plus vesimäärä: 100 g + 5 g, kokonaismassa 105 g.

Tunnista kyseessä olevan kemikaalin massa. Kun sinun on löydettävä massaprosentti, ongelma haluaa sinun löytävän tietyn elementin (kyseessä olevan elementin) massan prosentteina kaikkien elementtien kokonaismassasta. Huomaa kyseisen elementin massa. Tämä arvo on osoittaja massaprosentin laskennassa.- Esimerkiksi alkuaineen massa on 5 g natriumhydroksidia.
- Korvaa muuttujat massaprosenttikaavassa. Kun olet määrittänyt kullekin muuttujalle arvot, korvaa ne yhtälössä.
- Esimerkiksi: massaprosentti = () x 100 = () x 100.

Laske massaprosentti. Nyt kun yhtälö on muodostettu, ratkaise se vain massaprosentin laskemiseksi. Jaa elementin massa yhdisteen kokonaismassalla ja kerro se 100: lla. Tuloksena saadaan kemiallisen alkuaineen prosentuaalinen massa.- Esimerkiksi: () x 100 = 0,04761 x 100 = 4,751%. Siten 5 g natriumhydroksidia 100 g: aan vettä liuotettuna on 4,751%.
Menetelmä 2/2: Massaprosentin löytäminen massailla, joita ei ole annettu
- Määritä yhdisteen massaprosentin yhtälö. Yhdisteen massaprosentin peruskaava on: massaprosentti = () x 100. Tulos on kerrottava lopulla 100: lla, jotta arvot voidaan ilmaista prosentteina.
- Kun et tiedä massa-arvoja, voit löytää yhdisteen alkuaineen prosentuaalisen massan käyttämällä moolimassaa.
- Esimerkiksi: Mikä on vedyn prosenttiosuus vesimolekyylissä?.
Kirjoita kemiallinen kaava. Jos jokaisen yhdisteen kemiallisia kaavoja ei toimiteta, sinun on kirjoitettava ne. Muussa tapauksessa siirry vaiheeseen "Etsi jokaisen elementin massa".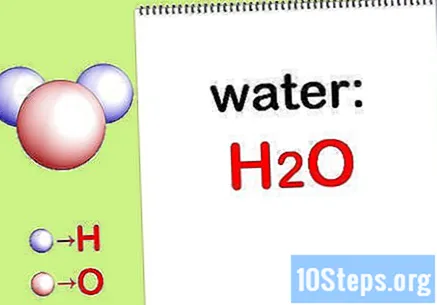
- Kirjoita esimerkiksi veden kemiallinen kaava: H2THE.
Etsi yhdisteen kunkin elementin massa. Etsi kemiallisten kaavojen kunkin elementin molekyylipaino viitaten jaksolliseen taulukkoon. Elementin massa löytyy yleensä kemiallisen elementin symbolin alapuolelta. Huomaa yhdisteen kunkin elementin massat.
- Esimerkiksi hapen molekyylipaino on 15,9994 ja vedyn 1,0079.
Kerro massat moolisuhteella. Määritä, kuinka monta moolia kustakin alkuaineesta on kemiallisessa yhdisteessä. Moolien lukumäärä saadaan yhdisteen tilatusta lukumäärästä. Kerro kunkin elementin molekyylimassa moolisuhteella.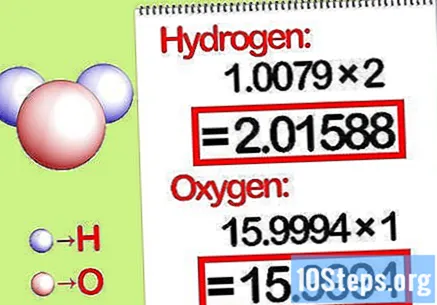
- Esimerkiksi vedyn ja hapen moolisuhde vedessä on 2: 1. Siksi kerrotaan vedyn molekyylipaino kahdella (1,00794 X2 = 2,01588) ja jätetään hapen molekyylipaino sellaisenaan (15,9994).
Laske yhdisteen kokonaismassa. Lisää yhdisteen kaikkien alkuaineiden kokonaismassa. Moolisuhteella laskettujen massojen avulla voidaan laskea yhdisteen kokonaismassa. Tämä luku on prosenttiosuuden yhtälön nimittäjä.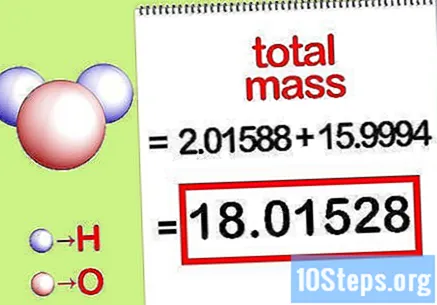
- Lisää esimerkiksi 2,01588 g / mol (kahden moolin vetyatomien massa) 15,9994 g / mol (yhden moolisen happiatomin massa) ja saa 18,01528 g / mol.
Tunnista kyseessä olevan elementin massa. Kun sinun on löydettävä massaprosentti, ongelma haluaa sinun löytävän yhdisteen tietyn elementin massan prosentteina kaikkien alkuaineiden kokonaismassasta. Tunnista kyseessä olevan elementin massa ja kirjoita se muistiin. Se on moolisuhteella laskettu massa-arvo. Tämä arvo on prosenttiosuuden yhtälön osoittaja.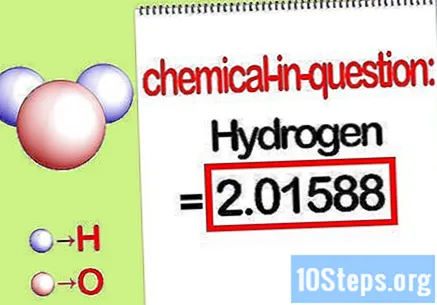
- Esimerkiksi yhdisteen vetymassa on 2,01588 g / mol (kahden moolin vetyatomien massa).
- Korvaa muuttujat massaprosenttikaavassa. Kun olet määrittänyt kullekin muuttujalle arvot, korvaa ne ensimmäisessä vaiheessa määritetyssä yhtälössä: massaprosentti = () x 100.
- Esimerkiksi: massaprosentti = () x 100 = () x 100.
Laske massaprosentti. Nyt kun yhtälö on muodostettu, ratkaise se vain massaprosentin laskemiseksi. Jaa elementin massa yhdisteen kokonaismassalla ja kerro se 100: lla. Tuloksena saadaan kemiallisen alkuaineen prosentuaalinen massa.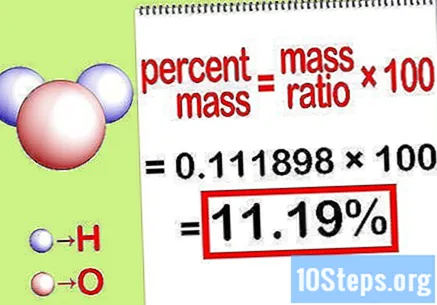
- Esimerkiksi massaprosentti = () x 100 = 0,1111189 x 100 = 11,18%. Siten vetyatomien massaprosentti vesimolekyylissä on 11,18%.