Kirjoittaja:
Robert Doyle
Luomispäivä:
18 Heinäkuu 2021
Päivityspäivä:
13 Saattaa 2024
Sisältö
Atomiluku vastaa protonien lukumäärää elementin yksittäisen atomin ytimessä. Tämä arvo ei muutu; Siksi voit käyttää sitä löytääksesi isotoopin muut ominaisuudet, kuten neutronien lukumäärän.
Askeleet
Osa 1/2: Atomiluvun löytäminen
Etsi kopio jaksollisesta taulukosta. Napsauta tätä, jos sinulla ei ole sellaista. Jokaisella elementillä on oma atominumero; Siksi sisällön oppimiseen ei ole oikotietä. Käytä taulukon kopiota tai yritä muistaa se.
- Useimmissa kemiankirjoissa taulukko on painettu takakannelle.

Etsi taulukosta elementti, jota opit. Useimmat taulukot sisältävät alkuaineiden täydellisen nimen sekä niiden symbolit (esimerkiksi Hg elohopealle). Jos et löydä etsimääsi, siirry verkkoon ja tee haku termeillä "kemiallinen symboli" ja elementin nimellä.
Etsi elementin atominumero. Se on yleensä elementin talon vasemmassa tai oikeassa yläkulmassa, mutta se voi tulla myös muualle. Lisäksi se on aina kokonaislukuarvo.- Jos numero sisältää desimaalipilkun, se todennäköisesti ilmoittaa atomimassan.
Vahvista tiedot lähellä olevien elementtien mukaan. Jaksollinen taulukko on järjestetty atomilukujen järjestyksen mukaan. Jos isotooppinumero on esimerkiksi "33", vasemmalla oleva elementti on "32" ja oikealla oleva "34". Siinä tapauksessa se johtuu siitä, että katsot atomilukua.
- Elementtien "56" (barium) ja "88" (radio) välillä on hyppy. Tätä aluetta vastaavat isotoopit ovat kahdessa rivissä taulukon alapuolella. Ne erotetaan vain näin, jotta pöytä ei ole liian iso.

Ymmärrä mitä atomiluku tarkoittaa. Atomiluvulla on yksinkertainen määritelmä: protonien määrä alkuaineen atomissa. Tämä protonimäärä puolestaan määrää ytimen kokonaissähkövarauksen - mikä sen vuoksi määrittää, kuinka monta elektronia atomi voi ladata. Koska elektronit ovat vastuussa melkein kaikista kemiallisista vuorovaikutuksista, atomiluku vaikuttaa epäsuorasti alkuaineen fysikaalisiin ja kemiallisiin ominaisuuksiin.- Toisin sanoen kukin atomi, jossa on kahdeksan protonia, vastaa happiatomia. Kahdella happiatomilla voi olla erilainen määrä neutroneja tai (jos yksi on ioneja) tai elektroneja, mutta niillä on aina kahdeksan protonia.
Osa 2/2: Tärkeämmän tiedon löytäminen
Määritä atomipaino. Se tulee yleensä jaksollisen taulukon elementin nimen alle ja siinä on kaksi tai kolme desimaalia. Atomipaino vastaa elementin atomien keskimääräistä massaa, mikä edustaa sen esiintymistä luonnossa. Se mitataan "atomimassayksiköinä" ("u" tai "u.m.a").
- Monet tutkijat käyttävät mieluummin termiä "atomimassa" painon sijaan.
Ymmärrä atomimassa. Atomimassan käsite on hyvin samanlainen kuin painon. Erona on, että paino osoittaa minkä tahansa alkiossa olevan atomin, ei tietyn atomin, keskimääräisen massan. Esimerkiksi: gramma rautaa sisältää useita atomeja, joiden massa vaihtelee; paino osoittaa niiden "suhteellisen massan". Jos tutkit yksittäistä elementin atomia, sinun on vain tiedettävä sen erityinen massa.
- Yleensä kemian ongelmat, joihin liittyy pelkästään atomeja, ilmoittavat jo atomimassan numeron. Sinun tarvitsee vain ymmärtää käsite, jotta et jää epäselväksi, kun näet toisen arvon.
Pyöristä massanumero. Massaluku vastaa protonien ja neutronien kokonaismäärää alkuaineen atomissa. Sen laskeminen ei ole vaikeaa: ota vain jaksolliseen taulukkoon painettu atomimassa ja pyöristä se lähimpään kokonaisarvoon.
- Tämä toimii, koska neutronien ja protonien määrät ovat hyvin lähellä 1 u.m.a, kun taas elektronien määrä on hyvin lähellä nollaa. Atomimassaan liittyy tarkkoja laskutoimituksia desimaaliarvon määrittämiseksi, mutta ainoat tärkeät tiedot ovat kokonaisluvut, jotka kertovat kuinka monta protonia ja neutronia on.
- Muista, että jos käytät atomimassaa, aiot sekoittaa elementin tietyn atomin painon. Esimerkiksi brominäytteen atomimassa on 79 tai 81.
Laske neutronien määrä. Nyt tiedät jo, että atomiluku on yhtä suuri kuin protonien lukumäärä ja että massanumero on yhtä suuri kuin protonien ja neutronien lukumäärän summa. Määritä neutronien määrä elementissä yksinkertaisesti vähentämällä atomiluku kokonaismassasta. Joitain esimerkkejä:
- Heliumatomin (He) massaluku on 4 ja atomiluku 2. Siksi 4 - 2 = 2 neutronia.
- Hopeanäytteen (Ag) keskimääräinen massaluku on 108 (jaksollisen taulukon mukaan) ja atomiluku 47. Keskimäärin jokaisella näytteen atomilla on 108 - 47 = 61 neutronia.
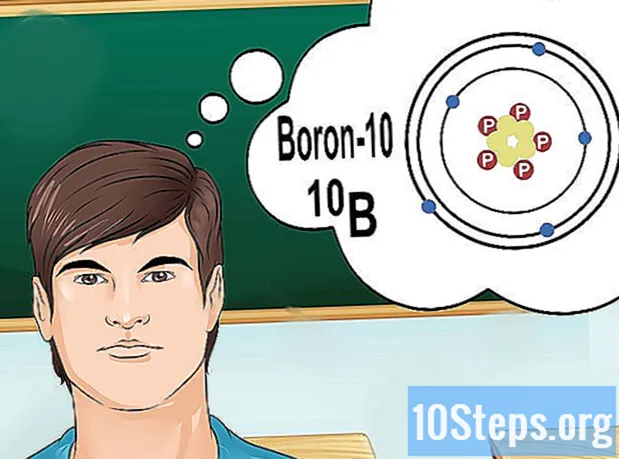
Ymmärrä isotoopit. Isotooppi on erityinen elementin muoto, joka sisältää useita neutroneja. Jos ratkaistava ongelma tuo jotain "boori-10" tai "B", se johtuu siitä, että puhut boorin alkuaineista, joiden massanumero on 10. Käytä tätä arvoa, älä "normaaleja" arvoja booria.
- Isotooppien atomimäärä ei koskaan muutu. Jokaisella elementin isotoopilla on sama määrä protoneja.
Vinkkejä
- Joidenkin raskaampien alkuaineiden atomipaino tulee suluissa tai hakasulkeissa. Tämä tarkoittaa, että tämä paino on vakaan isotoopin tarkka massa, ei useiden isotooppien keskiarvo. Lopuksi, tämä ei vaikuta elementin atomilukuun.