Sisältö
Muut osiotKemiassa valenssielektronit ovat elektroneja, jotka sijaitsevat elementin uloimmassa elektronikuoressa. Tieto siitä, kuinka löytää valenssielektronien määrä tietystä atomista, on tärkeä kemistien taito, koska tämä tieto määrittää, minkä tyyppisiä kemiallisia sidoksia ne voivat muodostaa, ja siten elementin reaktiivisuuden. Onneksi kaikki mitä tarvitset elementin valenssielektronien löytämiseen, on tavallinen alkuaineiden jaksollinen taulukko.
Askeleet
Osa 1/2: Valenssielektronien löytäminen jaksollisella taulukolla
Siirtymättömät metallit
Löydä jaksollinen elementtitaulukko. Tämä on värikoodattu taulukko, joka koostuu monista eri neliöistä ja jossa luetellaan kaikki ihmiskunnan tuntemat kemialliset alkuaineet. Määräajotaulukko paljastaa paljon tietoa elementeistä - käytämme joitain näistä tiedoista selvittämään valenssielektronien määrän tutkittavassa atomissa. Löydät nämä yleensä kemiaoppaiden kannesta. Täältä löytyy myös erinomainen interaktiivinen taulukko.

Merkitse kukin sarake jaksollisen taulukon elementeistä 1-18. Yleensä jaksollisessa taulukossa kaikilla yhden pystysarakkeen elementeillä on sama määrä valenssielektroneja. Jos jaksollisessa taulukossa ei ole jo kaikkia sarakkeita numeroitu, anna kullekin numero, joka alkaa numerosta 1 vasemmalle ja oikean puolen loppuun. Tieteellisesti näitä sarakkeita kutsutaan elementiksi "ryhmät".- Esimerkiksi, jos olisimme työskennelleet jaksollisen taulukon kanssa, jossa ryhmiä ei ole numeroitu, kirjoitamme 1 vedyn yläpuolelle (H), 2 yläpuolelle berylliumia (Be) ja niin edelleen, kunnes 18 kirjoitetaan heliumin (Hän) yläpuolelle. .

Etsi elementti pöydältä. Etsi nyt taulukosta elementti, jolle haluat löytää valenssielektronit. Voit tehdä tämän sen kemiallisella symbolilla (kirjaimet kussakin laatikossa), sen atominumerolla (numero kunkin laatikon vasemmassa yläkulmassa) tai millä tahansa muulla taulukon käytettävissä olevalla tiedolla.- Etsitään esimerkiksi hyvin yleisen elementin valenssielektronit: hiili (C). Tämän elementin atomiluku on 6. Se sijaitsee ryhmän 14 yläosassa. Seuraavassa vaiheessa löydämme sen valenssielektronit.
- Tässä osiossa jätämme huomiotta siirtymämetallit, jotka ovat ryhmien 3 - 12 tekemän suorakulmion muotoisen lohkon elementit. Nämä elementit eroavat hieman muista, joten tämän alaluvun vaiheet voittivat '' Älä työskentele heidän kanssaan. Katso kuinka käsitellä näitä alla olevasta alaosasta.

Määritä valenssielektronien määrä ryhmänumeroilla. Ei-siirtymämetallin ryhmänumeroa voidaan käyttää valenssielektronien määrän löytämiseen kyseisen elementin atomista. ryhmänumeron yksi paikka on valenssielektronien määrä näiden alkioiden atomissa. Toisin sanoen:- Ryhmä 1: 1 valenssielektroni
- Ryhmä 2: 2 valenssielektronia
- Ryhmä 13: 3 valenssielektronia
- Ryhmä 14: 4 valenssielektronia
- Ryhmä 15: 5 valenssielektronia
- Ryhmä 16: 6 valenssielektronit
- Ryhmä 17: 7 valenssielektronia
- Ryhmä 18: 8 valenssielektronia (paitsi helium, jossa on 2)
- Koska esimerkissämme hiili on ryhmässä 14, voimme sanoa, että yhdellä hiiliatomilla on neljä valenssielektronia.
Siirtymämetallit
Etsi elementti ryhmistä 3-12. Kuten edellä todettiin, ryhmien 3 - 12 elementtejä kutsutaan "siirtymämetalleiksi" ja ne käyttäytyvät eri tavalla kuin muut elementit, kun on kyse valenssielektroneista. Tässä osassa selitämme, kuinka valenssielektroneja ei tietyssä määrin voida osoittaa näille atomille.
- Valitse esimerkiksi tantaali (Ta), elementti 73. Seuraavissa vaiheissa löydämme sen valenssielektronit (tai ainakin yrittää .)
- Huomaa, että siirtymämetallit sisältävät lantanidi- ja aktinidisarjat (kutsutaan myös "harvinaisiksi maametalleiksi") - kaksi riviä elementtejä, jotka yleensä sijoitetaan muun taulukon alapuolelle ja alkavat lantaanilla ja aktiniumilla. Kaikki nämä elementit kuuluvat ryhmä 3 jaksollisen taulukon.
Ymmärrä, että siirtymämetalleilla ei ole "perinteisiä" valenssielektroneja. Ymmärtäminen, miksi siirtymämetallit eivät todellakaan "toimi" kuten muut jaksolliset taulukot, vaatii vähän selitystä elektronien käyttäytymisestä atomissa. Katso alta nopea läpikäynti tai ohita tämä vaihe päästäksesi vastauksiin.
- Kun elektroneja lisätään atomiin, ne lajitellaan eri "orbitaaleiksi" - pohjimmiltaan erilaisille alueille ytimen ympärillä, joihin elektronit kokoontuvat. Yleensä valenssielektronit ovat uloimman kuoren elektroneja - toisin sanoen viimeiset lisätyt elektronit .
- Syistä, jotka ovat hieman liian monimutkaisia selittää tässä, kun elektronit lisätään uloimpiin d Siirtymämetallin kuori (lisää tästä alla), ensimmäiset kuoreen menevät elektronit pyrkivät toimimaan normaalien valenssielektronien tavoin, mutta sen jälkeen ne eivät toimi, ja muiden kiertoradan kerrosten elektronit toimivat joskus valenssielektroneina. Tämä tarkoittaa, että atomilla voi olla useita valenssielektroneja riippuen siitä, miten sitä käsitellään.
Määritä valenssielektronien määrä ryhmän numeron perusteella. Jälleen kerran tutkittavan elementin ryhmänumero voi kertoa sen valenssielektronit. Siirtymämetalleille ei kuitenkaan ole olemassa mallia, jota voit seurata - ryhmän numero vastaa yleensä mahdollista valenssielektronien määrää. Nämä ovat:
- Ryhmä 3: 3 valenssielektronia
- Ryhmä 4: 2 - 4 valenssielektronia
- Ryhmä 5: 2 - 5 valenssielektronia
- Ryhmä 6: 2-6 valenssielektronia
- Ryhmä 7: 2 - 7 valenssielektronia
- Ryhmä 8: 2 tai 3 valenssielektronia
- Ryhmä 9: 2 tai 3 valenssielektronia
- Ryhmä 10: 2 tai 3 valenssielektronia
- Ryhmä 11: 1 tai 2 valenssielektronia
- Ryhmä 12: 2 valenssielektronia
- Koska tantaali kuuluu ryhmään 5, esimerkissämme voimme sanoa, että sillä on välillä kaksi ja viisi valenssielektronia, tilanteesta riippuen.
Osa 2/2: Valenssielektronien etsiminen elektronikonfiguraatiolla
Opi lukemaan elektronikonfiguraatio. Toinen tapa löytää elementin valenssielektronit on jotain, jota kutsutaan elektronikonfiguraatioksi. Nämä saattavat näyttää aluksi monimutkaisilta, mutta ne ovat vain tapa edustaa elektronien kiertoratoja atomissa kirjaimilla ja numeroilla, ja ne ovat helppoja, kun tiedät mitä katsot.
- Tarkastellaan esimerkkiä natrium (Na) -elementin kokoonpanosta:
- 1s2s2p3s
- Huomaa, että tämä elektronikonfiguraatio on vain toistuva merkkijono, joka menee näin:
- (numero) (kirjain) (numero) (kirjain) ...
- ...ja niin edelleen. (numero) (kirjain) palo on elektroniradan nimi ja elektronien määrä siinä kiertoradalla - siinä kaikki!
- Joten esimerkiksi sanoisimme, että natriumilla on 2 elektronia 1s-kiertoradalla plus 2 elektronia 2s-kiertoradalla plus 6 elektronia 2p-kiertoradalla plus 1 elektroni 3s-kiertoradalla. Se on yhteensä 11 elektronia - natrium on alkuaine 11, joten tämä on järkevää.
- Muista, että jokaisella alikuorella on tietty elektronikapasiteetti. Niiden elektronikapasiteetit ovat seuraavat:
- s: 2 elektronikapasiteettia
- p: 6 elektronikapasiteettia
- d: 10 elektronikapasiteettia
- f: 14 elektronikapasiteettia
- Tarkastellaan esimerkkiä natrium (Na) -elementin kokoonpanosta:
Etsi tutkittavan elementin elektronikonfiguraatio. Kun tiedät elementin elektronikonfiguraation, sen valenssielektronien määrän löytäminen on melko yksinkertaista (lukuun ottamatta tietysti siirtymämetalleja.) Jos sinulle annetaan kokoonpano aloitusvaiheesta, voit siirtyä seuraavaan vaiheeseen. Jos sinun on löydettävä se itse, katso alla:
- Tarkasta oganessonin (Og), elementin 118 täydellinen elektronikonfiguraatio, joka on jaksollisen järjestelmän viimeinen elementti. Siinä on eniten elektroneja kaikista elementeistä, joten sen elektronikonfiguraatio osoittaa kaikki mahdollisuudet, joita voisit kohdata muissa elementeissä:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Nyt kun sinulla on tämä, sinun tarvitsee vain löytää toisen atomin elektronikonfiguraatio vain täyttämällä tämä kuvio alusta asti, kunnes elektronit loppuvat. Tämä on helpompaa kuin miltä se kuulostaa. Esimerkiksi, jos haluamme tehdä orbitaalikaavion kloorille (Cl), elementille 17, jossa on 17 elektronia, tekisimme sen näin:
- 1s2s2p3s3p
- Huomaa, että elektronien lukumäärä on yhteensä 17: 2 + 2 + 6 + 2 + 5 = 17. Sinun tarvitsee muuttaa vain viimeisen kiertoradan numero - loput ovat samat, koska viimeistä kiertoradat ovat täysin täynnä .
- Lisätietoja elektronikonfiguraatioista, katso myös tämä artikkeli.
- Tarkasta oganessonin (Og), elementin 118 täydellinen elektronikonfiguraatio, joka on jaksollisen järjestelmän viimeinen elementti. Siinä on eniten elektroneja kaikista elementeistä, joten sen elektronikonfiguraatio osoittaa kaikki mahdollisuudet, joita voisit kohdata muissa elementeissä:
Määritä elektronit kiertoradoille Octet-säännön avulla. Kun elektroneja lisätään atomiin, ne putoavat eri kiertoradoille yllä annetun järjestyksen mukaisesti - kaksi ensimmäistä menevät 1s-kiertoradalle, kaksi sen jälkeen menevät 2s-kiertoradalle, kuusi sen jälkeen 2p-kiertoradalle ja pian. Kun kyse on siirtymämetallien ulkopuolella olevista atomeista, sanomme, että nämä kiertoradat muodostavat "kiertoradan kuoret" ytimen ympärille, jolloin kukin peräkkäinen kuori on kauempana kuin aikaisemmat. Ensimmäisen kuoren lisäksi, johon mahtuu vain kaksi elektronia, jokaisessa kuoressa voi olla kahdeksan elektronia (lukuun ottamatta taas siirtymämetalleja käsiteltäessä). Tätä kutsutaan Octet-sääntö.
- Oletetaan esimerkiksi, että tarkastelemme elementtiä Boron (B). Koska sen atomiluku on viisi, tiedämme, että siinä on viisi elektronia ja sen elektronikonfiguraatio näyttää tältä: 1s2s2p. Koska ensimmäisellä kiertoradalla on vain kaksi elektronia, tiedämme, että Boronilla on kaksi kuorta: toisessa kaksi 1s-elektronia ja toisessa kolme elektronia 2s- ja 2p-orbitaaleista.
- Toisena esimerkkinä elementillä, kuten kloori (1s2s2p3s3p), on kolme kiertoradan kuorta: toisessa kaksi 1s-elektronia, toisessa kaksi 2s-elektronia ja kuusi 2p-elektronia ja toisessa kaksi 3s-elektronia ja viisi 3p-elektronia.
Etsi ulomman kuoren elektronien määrä. Nyt kun tiedät elementtisi elektronikuoret, valenssielektronien löytäminen on helppoa: käytä vain uloimman kuoren elektronien määrää. Jos ulkokuori on täynnä (toisin sanoen, jos siinä on kahdeksan elektronia tai ensimmäisessä vaipassa kaksi), elementti on inertti eikä reagoi helposti muiden elementtien kanssa. Jälleen kerran asiat eivät kuitenkaan noudata näitä siirtymämetalleja koskevia sääntöjä.
- Esimerkiksi, jos työskentelemme Boronin kanssa, koska toisessa kuoressa on kolme elektronia, voimme sanoa, että Boronilla on kolme valenssielektronit.
Käytä taulukon rivejä kiertoradan pikanäppäiminä. Jaksollisen taulukon vaakasuoria rivejä kutsutaan elementiksi "jaksot". Taulukon yläosasta alkaen jokainen jakso vastaa niiden lukumäärää elektronikuoret kauden atomeilla on. Voit käyttää tätä pikakuvakkeena määrittääksesi, kuinka monta valenssielektronia elementillä on - aloita vain jakson vasemmalta puolelta laskettaessa elektroneja. Jälleen kerran haluat jättää siirtymämetallit huomiotta tällä menetelmällä, joka sisältää ryhmät 3-12.
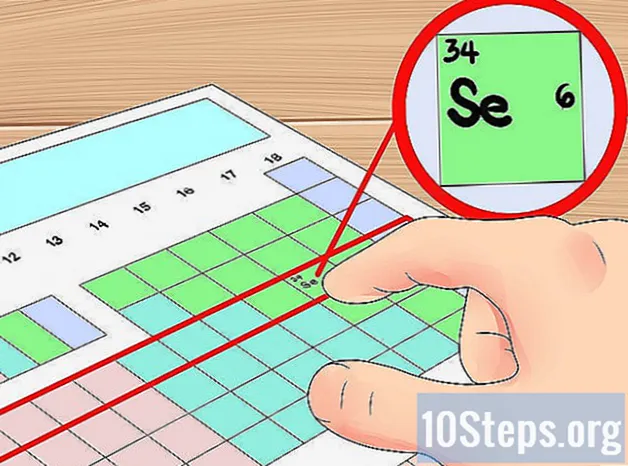
- Esimerkiksi tiedämme, että seleenielementillä on neljä kiertoradan kuorta, koska se on neljännellä jaksolla. Koska se on kuudes elementti vasemmalta neljännellä jaksolla (jättämättä siirtymämetalleja), tiedämme, että neljännellä ulkokuorella on kuusi elektronia, ja siten, että seleenillä kuusi valenssielektronia.
Yhteisökysymykset ja vastaukset
Kuinka laskemme valenssielektronin?
Valenssielektronit löytyvät määrittämällä elementtien elektroniset kokoonpanot. Sen jälkeen uloimman kuoren elektronien lukumäärä antaa kyseisen elementin valenssielektronien kokonaismäärän.
Jos atomissa on 33 elektronia, kuinka monta valenssielektronia on?
Jos atomi ei ole ioni, voimme sanoa, että atomissa on 33 protonia. Tämä tarkoittaa, että se on arseeni 33. Sitten tiedämme, että se ei ole siirtymämetalli, joten katsomme ja löydämme, että sen ryhmänumeron yksikkö on 5, mikä tarkoittaa, että siinä on 5 valenssielektronia.
Kuinka määritän heliumin atomiluvun?
Protonien lukumäärä on yhtä suuri kuin atomiluku.
Miksi elektronit saavat negatiivisen varauksen eikä positiivisen varauksen?
Atomit hankkivat tai menettävät elektroneja, negatiivisia varauksia, koska protoneilla on positiivinen varaus ja vahva ydinvoima pitää niitä ytimessä. Tämä on yksi maailmankaikkeuden neljästä erillisestä voimasta: painovoima, sähkömagnetismi, heikko voima ja vahva ydinvoima. Sen on oltava vahva, koska protonit karkottavat toisiaan, mutta ne ovat todella lähellä toisiaan ytimessä (yhdessä neutronien kanssa, joita myös voimakas voima pitää.) Ajatuksena on, että vahva voima on erittäin voimakas, mutta vain hyvin pienillä etäisyyksillä. Ajattele pieniä erittäin vahvoja koukkuja. Tarvitset voimia, kuten tähden, supernovan tai ydinräjähdyksen valtavan painovoiman, jotta protonit ja neutronit kytkeytyvät toisiinsa.
Mikä on jalokaasujen valance-elektroni?
Jalokaasuilla on kahdeksan valenssielektronia - alkuaineen vakain tila.
Miksi typessä on 6 valanssielektronia, mutta se on ryhmässä 15?
Typpissä on vain viisi valenssielektronia, koska se kuuluu ryhmään 5, vaikka se onkin itse asiassa ryhmässä 15, aiot jättää huomioimatta siirtymämetallit, koska näillä ryhmillä on erilainen tapa määrittää valenssielektroninsa. Siksi: ryhmä 13 tarkoittaa ryhmää 3 jne. Ja niin edelleen.
Atomissa on 7 protonia, 8 neuronia ja 7 elektronia. Mikä on elektronien määrä sen valenssikuoressa?
Elementti, joka sisältää 7 protonia, on typpi. Typpi on elementtisarakkeessa, jonka valenssikuoressa on 5 elektronia. Neutronien lukumäärällä ei ole merkitystä valenssielektronien määrän löytämisessä tietyssä elementissä.
Missä jaksollisessa taulukossa sijaitsevat atomit, joissa on seitsemän ulkokuorielektronia?
Katso toisesta viimeiseen sarakkeeseen oikealla puolella inerttien kaasujen vieressä.
Mikä on valenssielektroni?
Valenssielektroni on elektroni, joka löytyy atomin uloimmasta osasta ja joka voidaan jakaa tai ottaa reaktiossa.
Miksi jaksollisen taulukon elementeillä on erilainen määrä valenssielektroneja?
Niillä on erilaiset kemialliset rakenteet. Valenssielektronit luovat kemiallisia reaktioita.
Vinkkejä
- Huomaa, että elektronikonfiguraatiot voidaan kirjoittaa eräänlaisena lyhennelmänä käyttämällä jalokaasuja (ryhmän 18 elementit) seisomaan kiertoradalle konfiguraation alussa. Esimerkiksi natriumin elektronikonfiguraatio voidaan kirjoittaa 3s1 - pohjimmiltaan se on sama kuin neon, mutta 3s: n kiertoradalla on vielä yksi elektroni.
- Siirtymämetalleilla voi olla valenssiosakuoria, joita ei ole täysin täytetty. Valenssielektronien tarkan lukumäärän määrittäminen siirtymämetalleissa sisältää kvanttiteorian periaatteita, jotka eivät kuulu tämän artikkelin piiriin.
- Huomaa, että jaksolliset taulukot vaihtelevat maittain. Joten tarkista, että käytät oikeaa, päivitettyä sekaannusten välttämiseksi.
- Muista tietää, milloin viimeinen kiertorata lisätään tai vähennetään valenssielektronien löytämiseksi.
Tarvittavat asiat
- Elementtien jaksollinen taulukko
- Lyijykynä
- Paperi
Joka päivä wikiHow'ssa työskentelemme ahkerasti antaaksemme sinulle pääsyn ohjeisiin ja tietoihin, jotka auttavat sinua elämään parempaa elämää, riippumatta siitä, pitävätkö sinut turvallisempana, terveellisempänä tai hyvinvointina. Nykyisten kansanterveys- ja talouskriisien aikana, kun maailma muuttuu dramaattisesti ja me kaikki opimme ja sopeudumme päivittäisen elämän muutoksiin, ihmiset tarvitsevat wikiHow'ta enemmän kuin koskaan. Tuesi auttaa wikiHow'ta luomaan syvällisempiä kuvitettuja artikkeleita ja videoita ja jakamaan luotettavan opetussisällömme miljoonille ihmisille ympäri maailmaa. Harkitse osallistumista wikiHow: hon tänään.